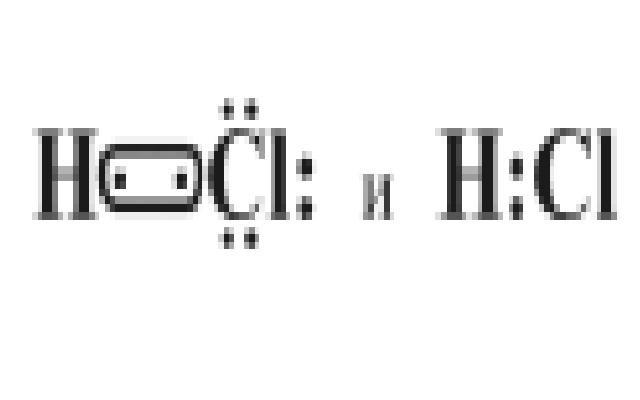Строение вещества, химическая связь и строение молекул
Пример 1. Описать свойства атома индия и его положение в периодической системе элементов.
Решение. Так как Z=49, заряд ядра атома Jn и общее количество электронов равны 49. Зная, что свойства атома определяет структура его валентных электронов, начнем с ее построения. Индий находится в 5 периоде IIIА группы, отсюда его валентные электроны имеют следующую структуру: 5S25P1. Наличие трех электронов на внешнем уровне и большой радиус атома (n = 5) предполагают достаточную легкость отдачи электронов (небольшая энергия ионизации) и как следствие – металлические свойства и достаточно высокую химическую активность.
Пример 2. Какую валентность, обусловленную неспаренными электронами (спинвалентность), может проявлять фосфор в нормальном и возбужденном* состояниях?
Решение. Распределени![]() е электронов внешнего энергетического уровня фосфора …3S23P3 (учитывая правило Хунда, 3S23Px3Pу3Pz) по квантовым ячейкам имеет вид:
е электронов внешнего энергетического уровня фосфора …3S23P3 (учитывая правило Хунда, 3S23Px3Pу3Pz) по квантовым ячейкам имеет вид:

Атомы фосфора имеют свободные d – орбитали,
поэтому возможен переход одного 3S – электрона в 3d – состояние:
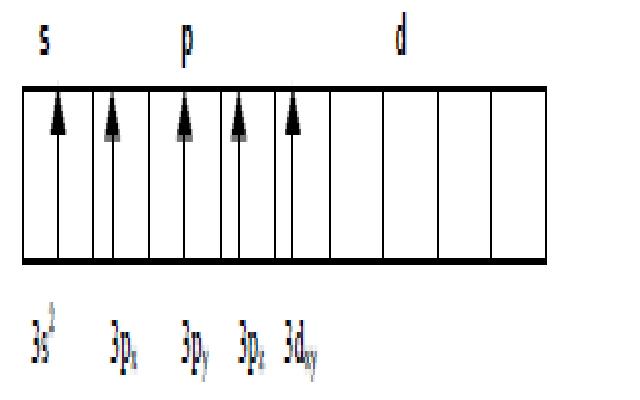
Отсюда валентность (спинвалентность) фосфора
в нормальном состоянии равна трем, а в возбужденном – пяти.
Пример 3. Укажите тип связей в молекулах
F2,
KCl, HCl. Приведите электронные модели их строения.
Решение.
1. Молекула F2 состоит из двух одинаковых атомов фтора, поэтому
ковалентная связь будет неполярной. Так как структура валентных электронов фтора
…2S22P5, строение молекулы можно представить:
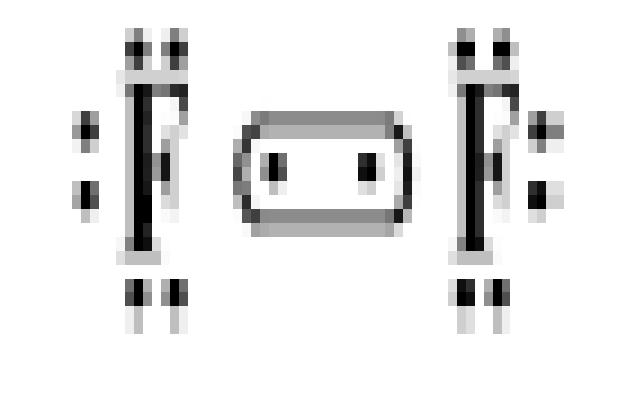
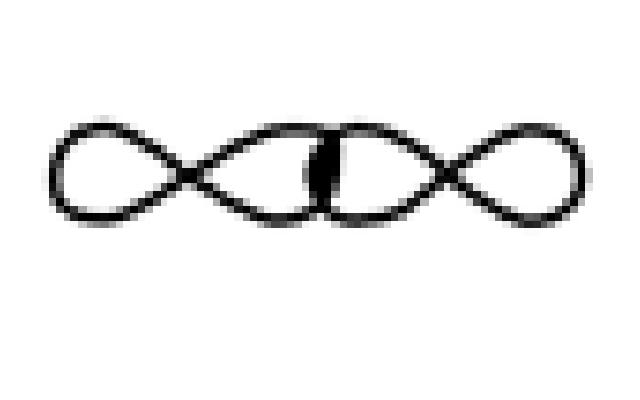
или перекрыванием одноэлектронных P-P орбиталей:
2. Молекула КСl состоит из двух резко отличающихся по электроотрицательности атомов металла (К) и неметалла (Сl), что определяет ионный тип связи;

3. Молекула НСl тоже состоит из двух разных атомов Н и Сl, поэтому в данном случае имеем ковалентную полярную связь, причем общая электронная пара смещена к более электроотрицательному атому хлора:
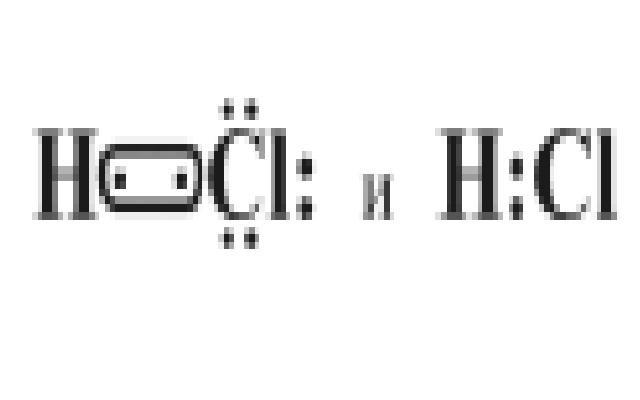
При этом происходит перекрывание S-P валентных орбиталей водорода и хлора:

Пример 4. Определите тип кристаллической решетки SiC и сделайте вывод о свойствах данного вещества.
Решение. Валентные электронные структуры кремния и углерода сходны (…3S23P2 и …2S22P2), поэтому в результате перекрывания они образуют ковалентную связь (малополярную). Так как их насыщаемость в соединении высока (четыре связи), вещество является твердым и образует атомную кристаллическую решетку. А это влечет за собой высокую твердость вещества, его тугоплавкость, малую растворимость и диэлектрические свойства.


![]()
![]()